BATERAI (AKI)
Disusun Untuk Memenuhi Tugas Mata Kuliah Kelistrikan Otomotif
Dosen Pengampu : Drs. C Sudibyo, M.T
Oleh :
RETNO DAMAYANTI
K2513056
PENDIDIKAN TEKNIK MESIN
FAKULTAS KEGURUAN DAN ILMU
PENDIDIKAN
UNIVERSITAS SEBELAS MARET SURAKARTA
KATA
PENGANTAR
Puji
syukur kami panjatkan kehadirat Allah SWT yang melimpahkan rahmat dan
hidayah-Nya sehingga penulis dapat menyelesaikan tugas makalah dengan Judul ”Baterai
(Aki) pada Kelistrikan Otomotif” dengan lancar.
Penulis
menyadari bahwa tanpa adanya bantuan dari berbagai pihak tidak dapat
menyelesaikan Makalah ini dengan baik. Pada kesempatan ini penulis ingin
mengucapkan terima kasih kepada :
1.
Tuhan
Yang Maha Esa yang telah memberikan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan makalah ini
dengan lancar tanpa ada halangan.
2.
Dosen
pembimbing Mata Kuliah Teknologi Pembelajaran, Bapak Drs. C. Sudibyo, M.T. yang telah membimbing dalam
penyusunan makalah ini.
3.
Orang
tua yang senantiasa memberikan dukungan dan doa sehingga penulis dapat
menyelesaikan makalah.
4.
Teman-teman
mahasiswa/mahasiswi lainnya yang telah memberikan masukan demi kesempurnaan
makalah ini.
Penulis
menyadari bahwa makalah ini masih jauh dari sempurna, oleh karena itu penulis
mengharapkan saran dan kritik yang bersifat membangun. Semoga makalah ini
bermanfaat bagi penulis khususnya dan pembaca pada umumnya.
Surakarta,9
Maret 2015
DAFTAR ISI
HALAMAN JUDUL.......................................................................................... i
KATA PENGANTAR....................................................................................... ii
DAFTAR ISI....................................................................................................... iii
BAB I PENDAHULUAN
A.
Latar Belakang.......................................................................................... 1
B.
Rumusan Masalah..................................................................................... 1
C.
Tujuan........................................................................................................ 2
BAB II LANDASAN
TEORI
A.
Pengertian dan Sejarah Baterai................................................................. 3
B.
Jenis Baterai.............................................................................................. 5
BAB III
PEMBAHASAN
A.
Komponen Baterai (Aki)........................................................................... 15
B.
Reaksi Kimia Baterai (Aki).......................................................................
C.
Rangkaian Instalasi Pemakaian Baterai (Aki)........................................... 20
D.
Rangkaian Instalasi Pengisian Baterai (Aki)............................................. 23
E.
Rating Kapasitas
Baterai (Aki)................................................................. 24
F.
Stiker
Spesifikasi Baterai (Aki)................................................................. 25
G.
Pemeriksaan
Baterai (Aki)......................................................................... 26
H.
Perawatan dan
Perbaikan Baterai (Aki).................................................... 27
BAB III
A.
Kesimpulan ............................................................................................... 30
B.
Saran.......................................................................................................... 34
DAFTAR
PUSTAKA......................................................................................... 35
BAB I
PENDAHULUAN
A.
Latar Belakang
Di era yang penuh teknologi seperti
sekarang ini, banyak sekali hal-hal baru ataupun hasil dari produk teknologi
yang sering bahkan wajib kita gunakan untuk menunjang aktivitas kita. Salah
satunya adalah alat-alat kelistrikan, alat-alat ini secara langsung ataupun
tidak langsung dapat memberikan pengaruh positif yang sangat besar dalam
memaksimalkan dan merealisasikan tujuan dari kegiatan kita, alasan efisiensi
waktu adalah tajuk utama mengapa alat-alat kelistrikan digunakan.
Dari banyak alat-alat kelistrikan
tersebut, penggunaan dan pemanfaatan baterai tidak mungkin dilepaskan dari
aktivitas manusia di era sekarang ini, handphone, laptop, bahkan televisi
sekalipun tidak mungkin terlepas dari peran sebuah baterai. Tapi, apakah kita
semua tahu, bagaimana baterai itu bekerja, komponenen apasaja yang terdapat
dalam baterai itu sendiri, tentu pemahaman dan informasi tentang baterai masih
banyak diantara kita yang belum memahami.
Oleh karena alasan tersebut, maka
dalam penulisan makalah ini penulis akan
mengangkat judul yakni “Baterai (Aki) pada Kelistrikan Otomotif”.
B.
Rumusan Masalah
1.
Komponen apa saja yang terdapat dalam baterai (aki) ?
3.
Bagaimana
rangkaian instalasi pemakaian baterai (aki) ?
4.
Bagaimana
rangkaian instalasi pengisian baterai (aki) ?
5.
Bagaimana
rating kapasitas baterai (aki) ?
6.
Bagaimana
stiker spesifikasi baterai (aki) ?
7.
Bagaimana
pemeriksaan pada baterai (aki)?
8.
Bagaimana
perawatan dan perbaikan pada baterai (aki) ?
C. Tujuan
1.
Mengetahui komponen
baterai (aki).
2.
Mengetahui
reaksi kimia baterai (aki).
3.
Mengetahui
rangkaian instalasi pemakaian baterai (aki).
4.
Mengetahui
rangkaian instalasi pengisian baterai (aki).
5.
Mengetahui rating
kapasitas baterai (aki).
6.
Mengetahui
stiker spesifikasi baterai (aki).
7.
Mengetahui
pemeriksaan pada baterai (aki).
8.
Mengetahui
perawatan dan perbaikan pada baterai (aki).
BAB II
LANDASAN
TEORI
A. Pengertian dan
Sejarah Baterai
Baterai
adalah alat yang mampu menghasilkan energi listrik dengan menggunakan energi
kimia. Baterai belumlah dikenal di zaman dahulu kala. Orang-orang bahkan
belum mengenal listrik. Penerangan hanya bersumber dari api. Seiring dengan
kemajuan zaman, orang-orang terus berfikir untuk
menemukan kehidupan yang lebih efisien. Manusia terus melakukan
penelitian-penelitian untuk menemukan suatu cara hidup yang lebih maju.
Berawal dari
penemuan artifak kuno yang ternyata berupa baterai sederhana di Baghdad pada
tahun 1930, membuat perhatian dunia tertuju pada berbagai penelitian untuk
pengembangan baterai serta pembuatan baterai. Penemuan artifak di Baghdad
tersebut menunjukkan bahwa awal mula ditemukannya baterai adalah di Baghdad di
mana ilmuwan Islamlah yang mempunyai kontribusi terbesar pada sejarah awal
perkembangan baterai. Namun, yang tercatat secara pasti dalam sejarah adalah
yakni jenis-jenis baterai awal yang dibuat oleh manusia yakni sel Daniell, sel
Leclanche, dan sel aki.
Kajian-kajian
mendalam mengenai konsep dasar yang dikembangkan dengan penelitian
berkelanjutan akhirnya menuju pada suatu hal yang semakin maju seperti yang
kita rasakan sekarang. Konsep-konsep dasar itu antara lain hantaran elektrolit,
oksidasi-reduksi, dan sel elektrokimia. Hantaran
elektrolit mencakup kemampuan suatu larutan untuk menghantarkan listrik
akibat dicelupnya dua buah elektroda (katoda dan anoda). Oksidasi-reduksi adalah suatu konsep
untuk menyatakan kemampuan suatu sel elektrokimia untuk mengadakan serah-terima
elektron. Adapun sel elektrokimia
adalah sel yang mampu mengubah energi listrik menjadi energi kimia atau
sebaliknya serta terdiri dari dua buah elektroda (katoda dan anoda) yang
dicelupkan pada suatu larutan elektrolit dengan atau tanpa jembatan garam.
Untuk
mengembangkan suatu penelitian khususnya dalam hal baterai, sangat perlu untuk
menengok akan sejarah penemuan dan pembuatan baterai karena dengan berbekal
sejarahlah seseorang dapat mengembangkan sesuatu yang lebih maju dan inovatif.
Sejarah menjadi sebuah modal penting dalam perkembangan zaman. Dalam makalah
ini, akan dibahas mengenai sejarah baterai (awal mula ditemukannya baterai).
Baterai atau aki adalah sebuah sel
listrik dimana di dalamnya berlangsung proses elektrokimia yang reversibel
(dapat berbalikan) dengan efisiensinya yang tinggi. Definisi lain dari baterai adalah alat untuk menyimpan tenaga listrik
melalui proses elektrokimia sehingga sumber tenaga listrik dapat diubah menjadi
tenaga kimia dan sebaliknya. Yang dimaksud dengan proses elektrokimia reversibel,
adalah di dalam baterai dapat berlangsung proses pengubahan kimia menjadi
tenaga listrik (proses pengosongan), dan sebaliknya dari tenaga listrik menjadi
tenaga kimia, pengisian kembali dengan cara regenerasi dari elektroda-elektroda
yang dipakai, yaitu dengan melewatkan arus listrik dalam arah (polaritas) yang
berlawanan di dalam sel.
Fungsi baterai atau
aki pada mobil berfungsi untuk menyimpan energi listrik dalam bentuk energi
kimia yang akan
digunakan untuk mensuplai (menyediakan) listik ke sistem starter, sistem
pengapian, lampu-lampu dan komponen komponen kelistrikan lainnya. Alat ini
menyimpan listrik dalam bentuk energi kimia, yang dikeluarkannya bila diperlukan dan
mensuplainya ke masing-masing sistem kelistrikan atau alat yang memerlukannya.
Karena di dalam proses baterai kehilangan energi kimia, maka alternator
mensuplainya kembali ke dalam baterai (yang disebut pengisian). Baterai
menyimpan listrik dalam bentuk energi kimia. Siklus pengisian dan pengeluaran
ini terjadi berulang kali dan terus menerus.
Setiap Baterai terdiri dari
Terminal Positif (Katoda)
dan Terminal Negatif (Anoda) serta Elektrolit yang berfungsi sebagai
penghantar. Output Arus Listrik dari Baterai adalah Arus Searah atau disebut
juga dengan Arus DC (Direct Current).
Pada umumnya, Baterai terdiri dari empat Jenis utama yakni Baterai Primer
yang hanya dapat sekali pakai (single use
battery) dan Baterai Sekunder yang dapat diisi ulang (rechargeable battery) serta Tipe Baterai Basah dan Kering.
1. Baterai Primer (Baterai Sekali Pakai/Single Use)
Baterai Primer atau
Baterai sekali pakai ini merupakan baterai yang paling sering ditemukan di
pasaran, hampir semua toko dan supermarket menjualnya. Hal ini dikarenakan
penggunaannya yang luas dengan harga yang lebih terjangkau. Baterai jenis ini
pada umumnya memberikan tegangan 1,5 Volt dan terdiri dari berbagai jenis
ukuran seperti AAA (sangat kecil), AA (kecil) dan C (medium) dan D (besar).
Disamping itu, terdapat juga Baterai Primer (sekali pakai) yang berbentuk kotak
dengan tegangan 6 Volt ataupun 9 Volt.
Jenis-jenis Baterai
yang tergolong dalam Kategori Baterai Primer (sekali Pakai / Single use) diantaranya adalah :
a. Baterai Zinc-Carbon (Seng-Karbon)
Baterai Zinc-Carbon juga disering disebut dengan
Baterai “Heavy Duty” yang sering kita
jumpai di Toko-toko ataupun Supermarket. Baterai jenis ini terdiri dari bahan
Zinc yang berfungsi sebagai Terminal Negatif dan juga sebagai pembungkus
Baterainya. Sedangkan Terminal Positifnya adalah terbuat dari Karbon yang
berbentuk Batang (rod). Baterai jenis Zinc-Carbon
merupakan jenis baterai yang relatif murah dibandingkan dengan jenis lainnya.
b. Baterai Alkaline (Alkali)
Baterai Alkaline ini
memiliki daya tahan yang lebih lama dengan harga yang lebih mahal dibanding
dengan Baterai Zinc-Carbon.
Elektrolit yang digunakannya adalah Potassium hydroxide yang merupakan Zat
Alkali (Alkaline) sehingga namanya
juga disebut dengan Baterai Alkaline. Saat ini, banyak Baterai yang menggunakan
Alkaline sebagai Elektrolit, tetapi mereka menggunakan bahan aktif lainnya
sebagai Elektrodanya.
Anoda Zn (-) = Zn à
Zn²⁺ + 2e⁻
Katoda C (+) = 2MnO2 + 2NH4⁺ 2e à Mn2O3 + 2NH3 + H2O
Reaksinya :
Anoda (-) : Zn + 2OH → ZnO + H₂O + 2e⁻
Anoda (-) : Zn + 2OH → ZnO + H₂O + 2e⁻
Katoda(+) : 2MnO2+
H₂O + 2e⁻→Mn₂O₃+
2OH
Kelebihan :
Sangat baik dioperasikan pada temperatur
rendah sampai -25 0C
Kekurangan :
Densitas energinya rendah , Sekali pakai.
c. Baterai Lithium
Baterai Primer Lithium menawarkan kinerja yang lebih
baik dibanding jenis-jenis Baterai Primer (sekali pakai) lainnya. Baterai
Lithium dapat disimpan lebih dari 10 tahun dan dapat bekerja pada suhu yang
sangat rendah. Karena keunggulannya tersebut, Baterai jenis Lithium ini sering
digunakan untuk aplikasi Memory Backup pada Mikrokomputer maupun Jam Tangan.
Baterai Lithium biasanya dibuat seperti bentuk Uang Logam atau disebut juga
dengan Baterai Koin (Coin Battery).
Ada juga yang memanggilnya Button Cell atau Baterai Kancing.
d. Baterai Silver Oxide
Baterai Silver Oxide merupakan jenis baterai
yang tergolong mahal dalam harganya. Hal ini dikarenakan tingginya harga Perak
(Silver). Baterai Silver Oxide dapat dibuat untuk menghasilkan Energi yang
tinggi tetapi dengan bentuk yang relatif kecil dan ringan. Baterai jenis Silver
Oxide ini sering dibuat dalam dalam bentuk Baterai Koin (Coin Battery) / Baterai Kancing (Button Cell). Baterai jenis Silver
Oxide ini sering dipergunakan pada Jam Tangan, Kalkulator maupun aplikasi
militer.
e.
Baterai Zinc Air Cell
Merupakan baterai
standart yang digunakan pada alat bantu dengar. Sangat tahan lama, dan hanya
memiliki anoda, katodanya memanfaatkan udara di sekitar.
2. Baterai Sekunder (Baterai Isi Ulang/Rechargeable)
Baterai Sekunder
adalah jenis baterai yang dapat di isi ulang atau Rechargeable Battery. Pada prinsipnya, cara Baterai Sekunder
menghasilkan arus listrik adalah sama dengan Baterai Primer. Hanya saja, Reaksi
Kimia pada Baterai Sekunder ini dapat berbalik (Reversible). Pada saat Baterai digunakan dengan menghubungkan beban
pada terminal Baterai (discharge),
Elektron akan mengalir dari Negatif ke Positif. Sedangkan pada saat Sumber
Energi Luar (Charger) dihubungkan ke
Baterai Sekunder, elektron akan mengalir dari Positif ke Negatif sehingga
terjadi pengisian muatan pada baterai. Jenis-jenis Baterai yang dapat di isi
ulang (rechargeable Battery) yang sering kita temukan antara lain seperti
Baterai Ni-cd (Nickel-Cadmium), Ni-MH
(Nickel-Metal Hydride) dan Li-Ion (Lithium-Ion).
Jenis-jenis Baterai
yang tergolong dalam Kategori Baterai Sekunder (Baterai Isi Ulang) diantaranya
adalah :
a. Baterai Ni-Cd (Nickel-Cadmium)
Anode: Cd(s) + 2OH-(aq) à Cd(OH)2(s) + 2e
Katode: NiO2(s) + 2H2O(l)
+ 2e àNi(OH)2(s) +
2OH-(aq) +
Cd(s) + NiO (s) + 2H2O(l)
à Cd(OH)2(s)
+ Ni(OH)2(s)
Kelebihan :
Murah , mudah dibawa/disimpan , dapat
diperoleh dalam berbagai ukuran.
Kekurangan :
Pada pengeluaran arus yang tinggi mengeluarkan air, membebaskan gas amoniak [NH3(g)],
yang menyebabkan turunnya tegangan.
b. Baterai Ni-MH (Nickel-Metal Hydride)
Baterai Ni-MH (Nickel-Metal Hydride) memiliki
keunggulan yang hampir sama dengan Ni-Cd, tetapi baterai Ni-MH mempunyai
kapasitas 30% lebih tinggi dibandingkan dengan Baterai Ni-Cd serta tidak memiliki
zat berbahaya Cadmium yang dapat merusak lingkungan dan kesehatan manusia.
Baterai Ni-MH dapat diisi ulang hingga ratusan kali sehingga dapat menghemat
biaya dalam pembelian baterai. Baterai Ni-MH memiliki Self-discharge sekitar
40% setiap bulan jika tidak digunakan. Saat ini Baterai Ni-MH banyak digunakan
dalam Kamera dan Radio Komunikasi. Meskipun tidak memiliki zat berbahaya
Cadmium, Baterai Ni-MH tetap mengandung sedikit zat berbahaya yang dapat
merusak kesehatan manusia dan Lingkungan hidup, sehingga perlu dilakukan daur
ulang (recycle) dan tidak boleh
dibuang di sembarang tempat.
c. Baterai Li-Ion (Lithium-Ion)
Baterai jenis Li-Ion
(Lithium-Ion) merupakan jenis Baterai
yang paling banyak digunakan pada peralatan Elektronika portabel seperti Digital
Kamera, Handphone, Video Kamera ataupun Laptop. Baterai Li-Ion memiliki daya
tahan siklus yang tinggi dan juga lebih ringan sekitar 30% serta menyediakan
kapasitas yang lebih tinggi sekitar 30% jika dibandingkan dengan Baterai Ni-MH.
Rasio Self-discharge adalah sekitar 20% per bulan. Baterai Li-Ion lebih ramah
lingkungan karena tidak mengandung zat berbahaya Cadmium. Sama seperti Baterai
Ni-MH (Nickel- Metal Hydride),
Meskipun tidak memiliki zat berbahaya Cadmium, Baterai Li-Ion tetap mengandung
sedikit zat berbahaya yang dapat merusak kesehatan manusia dan Lingkungan
hidup, sehingga perlu dilakukan daur ulang (recycle)
dan tidak boleh dibuang di sembarang tempat.
d. Baterai Li-Po (Lithium-Polimer)
Dibandingkan dengan
Li-Ion, baterai Li-Po memiliki daya tahan jauh lebih baik terutama saat panas.
Dan bisa karena bahannya terbuat dari senyawa polimer, bentuknya bisa
flexsibel. Hanya saja lebih mahal dan masih jarang ditemukan dipasaran.
3.
Baterai Tipe Kering
4. Baterai Tipe Basah
a. Baterai
dengan Pengeluaran Gas
Baterai
dengan pengeluaran gas adalah baterai yang umum kita lihat sehari-hari terutama
pada sepeda motor di mana pada baterai ini dilengkapi dengan selang pengeluaran
gas yang berfungsi sebagai saluran pembuang gas hasil destilasi uap
cairan elektrolit ketika baterai diberikan beban listrik.
b. Baterai
dengan Sambungan Probe
Baterai ini
dilengkapi dengan sebuah probe yaitu semacam alat sensor yang dapat mendeteksi
tinggi atau rendah cairan elektrolit yang terdapat didalam baterai. Bila cairan
elektrolit di dalam baterai berada pada posisi Lower Level, otomatis probe akan mengirimkan sinyal dalam bentuk
bunyi yang akan memberitahukan pemilik kendaraan untuk melakukan pengisian
kembali cairan elektrolit.
c. Baterai Bebas
Pemeliharaan
Pada baterai
ini gas hasil destilasi yang seharusnya keluar melalui tutup baterai yang dapat
mengakibatkan korosif pada terminal baterai di gunakan kembali (reuse) di dalam
baterai itu sendiri sehingga memungkinkan pemilik kendaraan tidak terlalu repot
melakukan perawatan pada baterai jenis ini.
d.
Baterai “S”
Baterai
"S" bermakna Special atau khusus, karena baterai ini mempunyai
desain khusus terutama pada bagian separatornya yang berbeda dengan desain
separator pada umumnya.
BAB III
PEMBAHASAN
A. Komponen Baterai (Aki)
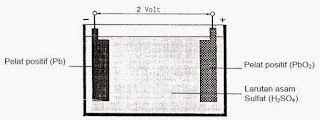
Di dalam baterai mobil terdapat
elektrolit asam sulfat, elektroda positif dan negatif dalam bentuk plat.
Plat-plat dibuat dari timah atau berasal dari timah. Karena itu baterai tipe
ini sering disebut baterai timah. Ruangan dalamnya dibagi menjadi beberapa sel
(biasanya 6 sel, untuk baterai mobil) dan di dalam masing-masing sel terdapat
beberapa elemen yang terendam di dalam elektrolit.
Baterai terdiri dari beberapa
komponen antara lain : Kotak baterai, terminal baterai, elektrolit
baterai, lubang elektrolit baterai, tutup baterai dan sel baterai. Dalam
satu baterai terdiri dari beberapa sel baterai, tiap sel menghasilkan tegangan
2 - 2,2 V. Baterai 6 V terdiri dari 3 sel, dan baterai 12 V mempunyai 6 sel
baterai yang dirangkai secara seri.
Tiap sel baterai mempunyai lubang
untuk mengisi elektrolit baterai, lubang tersebut ditutup dengan tutup baterai,
pada tutup terdapat lubang ventilasi yang digunakan untuk mengalirkan uap dari
elektrolit baterai. Tiap sel baterai terdapat plat positif, saparator
dan plat negatif, plat
positif berwarna
coklat gelap (dark brown) dan plat negatif berwarna
abu-abu metalik (metallic gray).
Komponen Baterai antara lain :
a.
Pembatas Dinding Sel
Pembatas dinding sel dari sel-sel
baterai, baik sel baterai positif maupun sel baterai negatif dengan
tujuan agar tidak terjadi hubungan singkat di antara sel-sel baterai
tersebut dan juga untuk menjembatani antara sel 1 hingga sel 6 yang mempunyai
nilai tegangan masing-masing sel yaitu 2 Volt.
b. Kotak baterai
Wadah yang menampung elektrolit dan
elemen baterai disebut kotak baterai. Ruangan didalamnya dibagi menjadi ruangan
sesuai dengan jumlah selnya. Pada kotak baterai terdapat garis tanda upper
level dan lower level , sebagai indikator jumlah
elektrolit. Dibuat dari ebonit atau plastik, wadah untuk accu 6 volt terbagi
atas 3 sel, dan untuk accu 12 volt terbagi atas 6 sel. Pada kotak baterai
terdapat garis tanda permukaan atas dan bawah (Upper dan Lower).
Pelat-pelat posisinya ditinggikan dari dasar dan diberi penyekat, tujuannya agar
tidak terjadi hubungan singkat apabila ada bahan aktif (timah dan lain-lain)
terjatuh dari pelat. Tutup baterai dibuat dari bahan yang sama seperti
bak/wadah.
c.
Tutup Kotak Baterai
Tutup kotak baterai
berada di bagian atas yang menjadi penutup dari sebuah kotak baterai yang
berfungsi melindungi komponen-komponen baterai bagian dalam dari kejatuhan
partikel kotoran dan debu yang beterbangan di dalam bengkel ataupun cairan
pelumas yang tertumpah secara tidak sengaja oleh teknisi bengkel.
d.
Terminal Baterai
Terminal baterai berfungsi sebagai
tempat mengikat kabel-kabel terminal baterai yang akan menuju kepada
terminal-terminal lain semisal terminal pada kunci kontak, desain terminal
baterai secara kasat mata tidak mempunyai perbedaan yang berarti namun bila kita
perhatikan secara seksama sebenarnya kedua terminal tersebut mempunyai diameter
yang berbeda antar terminal (+) dengan terminal (-). umumnya perbedaan tersebut
terletak pada terminal (+) yang mempunyai diameter terminalnya lebih besar dari
diameter terminal (-). Hal ini di desain dengan sengaja dengan tujuan untuk
menghindari kesalahan pemasangan oleh teknisi mesin ketika melihat tanda-tanda
(+) dan (-) yang tercetak dengan bentuk reflika timbul pada baterai telah
mengalami keruskan atau keausan.
e. Elektrolit Baterai
Elektrolit baterai merupakan
campuran antara air suling (H2O) dengan asam sulfat (SO4),
komposisi campuran adalah 64 % H2O dan dan 36 % SO4.
Dari campuran tersebut diperoleh elektrolit baterai dengan berat jenis 1,270.
Berat jenis elektrolit pada baterai saat ini dalam keadaan terisi penuh ialah 1,260
atau 1,280 (pada temperatur 200C). Perbedaan ini disebabkan
perbandingan antara air sulingan dengan asam sulfat pada masing-masing tipe
berbeda. Elektrolit yang berat jenisnya 1,260 mengandung 65% air sulingan dan
35% asam sulfat, sedangkan elektrolit yang berat jenisnya 1,280 mengandung 63%
air sulingan dan 37% asam sulfat. Pembetulan BJ = Harga pembacaan + 0,0007 x (Temp. elektrolit - 200C)
f. Sumbat Ventilasi
Sumbat
ventilasi ialah tutup untuk lubang pengisian elektrolit. Sumbat ini juga
berfungsi untuk memisahkan gas hidrogen (yang terbentuk saat pengisian) dan uap
asam sulfat di dalam baterai dengan cara membiarkan gas hidrogen keluar lewat
lubang ventilasi, sedangkan uap asam sulfat mengembun pada tepian ventilasi dan
menetes kembali ke bawah.
g. Pelat Positif dan Negatif
Pelat
positif dan negatif merupakan komponen utama suatu baterai. Kualitas pelat
sangat menentukan kualitas baterai tersebut, pelat-pelat tersebut terdiri dari
paduan timbal-antimon, yang diisi dengan suatu bahan aktif. Bahan aktif
pada pelat positif adalah Timbal
Peroksida
(PbO2) yang berbentuk kristal dengan butir-butir yang sangat kecil
dan berwarna kecoklat-coklatan. Sedang pada
pelat negatif adalah spons-timbal yang berwarna abu-abu.
Plat
Positif :
1.
Lead grid
2. Lead
peroxida (grid filling)
Plat Negatif :
1.
Lead grid
2. Lead sulfat
(grid filling)
Hal hal tentang plat :
1.
Plat positif terbuat dari lead peroxida
2.
Plat negatif terbuat dari spongy lead
3.
Biasanya plat negatif satu lebih banyak dari plat
positif, meskipun beberapa baterai memiliki jumlah kedua plat yang sama.
4.
Plat pembatas, terbat dari bahan isolasi dipasang
antara plat positif dan negatif.
5.
Kemasan baterai dibuat dari bahan plastik atau bahan
lain yang tahan terhadap asam.
6.
Cairan didalam baterai disebut sebagai elektrolit.
Cairan mengandung kira-kira 60% air dan 40% asam sulfat.
h. Separator dan Lapisan Serat (Fiber Glass)
Antara plat
positif dan negatif disisipkan lembaran separator yang terbuat dari serat
cellulosa yang diperkuat dengan resin. Lembaran lapisan serat gelas dipakai
untuk melindungi bahan aktif dari pelat positif, karena timbal peroksida
mempunyai daya kohesi yang lebih rendah dan mudah rontok jika dibandingkan
dengan bahan aktif dari pelat negatif. Selain itu lapisan serat gelas juga
berfungsi melindungi separator.
i.
Penghubung sel
Untuk
menghubungkan tiap-tiap sel dari sel-sel baterai pada sel baterai (-) dan
(+).Suatu baterai 12 volt mempunyai 6 sel, sedang baterai 6 volt mempunyai 3
sel. Sel merupakan unit dasar suatu baterai dan mempunyai voltase sebesar 2
volt. Penghubung sel ini terbuat dari paduan timbal-antimon. Ada dua cara
menghubungkan sel-sel tersebut. Yang pertama melalui atas dinding penyekat (Over
The Partition) dan yang kedua melalui dinding penyekat (Through The
Partition). Terminal terdapat pada kedua sel ujung, satu bertanda positif
(+) dan yang lain negatif (-). Melalui kedua terminal ini listrik dialirkan. Sel Baterai
untuk menambah daya baterai dalam satuan ampere.
j.
Separator
Separator berfungsi
untuk
memisahkan tiap-tiap sel (-) maupun sel (+). Cara merekatkan wadah dengan tutup
baterai ada tiga cara, yang pertama menggunakan sealing compound (aspal),
yang kedua menggunakan bahan perekat/lem, dan yang ketiga dengan bantuan panas
(heat sealing). Biasanya untuk yang pertama digunakan dengan wadah/tutup
ebonit, yang kedua untuk wadah polystyren, sedangkan yang ketiga untuk wadah
polypropylene.
k. Alas Baterai
Alas baterai mempunyai fungsi
sebagai kedudukan dan penumpu berat dari totalitas berat baterai, oleh karena
ketika membongkar atau memasang baterai hendaknya hati-hati agar kondisi
baterai tidak jatuh yang dapat menyebabkan pecah atau retak pada bagian alas
baterai sehingga cairan elektrolit pada baterai dapat merembes keluar (bocor
baterai).
Contoh Konstruksi Baterai Aki Mobil
dan Motor :
1.
Konstruksi sebuah sel
Konstruksi Sel Baterai Aki Mobil Dan
Motor Baterai terdiri dari beberapa sel dan setiap sel terdiri dari pelat
positif dan pelat negatif dan sel ini dibuat dari pelat logam timbel berpori,
dengan maksud dan tujuan untuk mempermudah reaksi kimia pada permukaan berpori
tersebut sedangkan bahan aktif dari pelat positif adalah timbel dioksida (PbO2)
berwarna coklat dan untuk pelat negatif adalah timbel (Pb) berwarna abu – abu.
Konstruksi Blok Sel Baterai Aki
Mobil Dan Motor
Batang penghubung sel-sel adalah
pelat – pelat yang tergabung di dalam blok blok sel dan pelat positif dibatasi
oleh isolasi (separator) yang terbuat dari ebonit atau pelastik kemudian blok –
blok sel ini dimasukkan dalam blok baterai yang diisi larutan asam sulfat
(H2SO4) serta setiap blok sel menghasilkan tegangan sebesar 2 Volt.
3. Hubungan
blok sel
Hubungan Sel Baterai Aki Mobil Dan
Motor
Tujuan dari menghubungkan blok –
blok sel secara seri adalah untuk memperoleh tegangan yang lebih tinggi
misalnya untuk memperoleh tegangan 12 Volt, baterai membutuhkan 6 blok sel yang
masing – masing bertegangan 2 Volt.
B.
Reaksi Kimia pada Baterai (Aki)
Baterai merupakan pembangkitan
listrik secara kimia. Listrik dibangkitkan akibat reaksi kimia antara plat
positif, elektrolit
baterai dan plat negatif. Saat
baterai dihubungkan dengan sumber listrik arus searah maka terjadi proses
pengisian (charge). Proses
tersebut secara kimia dapat dirumuskan sebagai berikut:
Katoda Pb (-) : PbSO4
+H2 → Pb+ H2 SO4
Anoda PbO2
(+) : PbSO4 + SO4+ 2H2O →
PbO2+ 2H2SO4
Reaksi total
: PbSO4 + 2H2O
+ PbSO4 à PbO2 + 2H2SO42- + Pb
Saat sistem starter berfungsi maka
energi listrik yang tersimpan di baterai akan mengalir ke beban, proses ini
sering disebut proses pengosongan (discharge).
Proses pengosongan secara kimia
dapat dirumuskan sebagai berikut:\
Anoda : PbO2
+ H2 + 2e + H2SO4 + à PbSO4 +2H2O
Katoda : Pb + SO4-
+ à PbSO4
Dari reaksi kimia tersebut
terdapat perbedaan elektrolit baterai saat kapasitas baterai penuh dan
kosong, dimana saat baterai penuh elektrolit terdiri
dari 2H2SO4, sedangkan saat kosong elektrolit baterai adalah
2H2O.
Proses Elektrokimia pada Baterai Mobil dan Motor :
1. Baterai
dalam keadaan saat di isi air dan diberi arus penuh

Proses Pengisian Baterai Arus Penuh
Saat baterai berisikan air asam
sulfat dan sudah dalam keadaan diberi arus penuh maka pada saat temperatur
20°C, berat jenis air baterai = 1,285 Kg/1 dan dalam keadaan ini bahan aktif
pada pelat positif adalah timbel dioksid (PbO2) bewarna coklat sedangkan pada
pelat negatif timbel (Pb) berwarna abu-abu.
2.
Baterai dalam keadaan dipakai

Proses Baterai Saat Terpakai
Saat baterai dalam keadaan dipakai
maka Oksigen (O2) yang berada pada pelat positif bereaksi dengan hidrogen (H)
dan membentuk air (H2O) dan pada waktu yang bersamaan membuat timbel Pb pada
pelat positif bereaksi dengan sisa asam (SO4) sehingga menjadi timbel sulfat
(PbSO4) sedangkan pada pelat negatif juga mengalami reaksi dengan sisa asam
(SO4) sehingga berubah menjadi timbel sulfat (PbSO4) pula.
3.
Baterai dalam keadaan kosong Proses Baterai Saat
Kondisi Kosong

Saat baterai dalam keadaan kosong
maka bila reaksi berlangsung terus menerus membuat arus listrik akan habis
sehingga asam sulfat terbagi menjadi dua bagian, satu bagian membentuk air
(H2O) dan bagian lain bereaksi dengan bahan pelat dan membentuk timbel sulfat
(PbO4) yang menyebabkan berat jenis elektrolit menurun 1,08 kg/l.
4.
Baterai dalam keadaan pengisian arus listrik

Proses Baterai Saat Pengisian Arus
Listrik
Saat baterai dalam pengisian arus
listrik membuat keadaan akan terbalik dikarenakan oksigen dalam asam baterai
bereaksi dengan timbel pada pelat positif sehingga sisa asam terurai dari pelat
– pelat dan bereaksi dengan hidrogen di dalam asam baterai. Maka hal ini akan
menambah besarnya berat jenis air baterai yang mana penambahan ini akan berlangsung
selama pengisian sampai berat jenis mencapai 1,285 kg/l sehingga dalam keadaan
ini baterai telah terisi penuh.
C.
Rangkaian Instalasi Pemakaian Baterai (Aki)
1. Rangkaian
seri

Pada Rangkaian Seri jika dua buah
baterai di jumper menjadi satu rangkaian, maka tegangannya akan bertambah
tetapi arusnya tetap.
2.
Rangkaian paralel

Pada Rangkaian Paralel jika dua buah
baterai di jumper menjadi satu, maka tegangannya tidak bertambah (tetap) tetapi
arusnya bertambah.
3. Rangkaian
seri parallel

Pada
Rangkaian Seri-Paralel, jika tiga buah baterai di jumper menjadi satu, maka
tegangannya bertambah, (terakumulasi hanya dua buah baterai) dan arusnya
pun bertambah lebih besar.
D.
Rangkaian Instalasi Pengisian Baterai (Aki)
1.
Pengisian lambat

Pengisian lambat membutuhkan waktu 6 - 8 jam
2. Pengisian cepat

Pengisian cepat membutuhkan waktu 3 jam
E.
Rating Kapasitas Baterai (Aki)
Energi yang tersimpan dalam baterai
harus cukup kuat untuk starter, untuk itu baterai harus terisi penuh. Kapasitas
baterai menunjukkan jumlah listrik yang disimpan baterai yang dapat dilepaskan
sebagai sumber listrik. Kapasitas baterai dipengaruhi oleh ukuran plat, jumlah
plat, jumlah sel dan jumlah elektrolit baterai. Terdapat 3 ukuran yang sering
menunjukkan kapasitas baterai, yaitu:
1.
Cranking
Current Ampere (CCA)
Kapasitas baterai tergantung pada
bahan plat yang bersinggungan dengan larutan elektrolit, bukan hanya jumlah
plat tetapi besar ukuran (luas permukaan singgung) pada plat yang akan
menentukan kapasitasnya. The Internasional standard memberikan nilai
untuk capasitas baterai dengan SAE Cranking
Current atau Cold
Cranking Current. Nilai CCA
dari suatu baterai adalah arus (dalam ampere) dari baterai yang diisi penuh
sehingga dapat memberikan arus untuk 30 detik pada 18 derajat Celsius selama
itu tetap menjaga tegangan setiap sel 1.2 volt atau lebih.
2.
Reserve
Capacity
Kapasitas layanan adalah banyaknya
waktu dalam menit pada baterai yang diisi penuh dapat memberikan arus sebesar
25 ampere pada 27 derajat Celsius setelah sistim pengisian dilepas.
Tegangan tidak boleh turun dibawah 1.75 volt per sel (10.5 volt total untuk
baterai 12 volt).
3. Ampere Hour
Kapasitas baterai adalah
banyaknya arus pada baterai yang diisi penuh dapat menyediakan arus selama 20
jam pada 27 derajat Celsius, tanpa penurunan tegangan tiap sel dibawah 1.75
volt. Sebagai contoh: Sebuah Baterai yang secara terus menerus mengalirkan 3
ampere untuk 20 jam dinilai memiliki 60 AH. Rumus menentukan kapasitas baterai adalah:
AH = A (amper) x H (Jam)
JIS mendefinisikan kapasitas baterai
sebagai jumlah listrik yang dilepaskan sampai tegangan pengeluaran akhir
menjadi 10,5 V dalam 5 jam. Sebagai contoh
baterai dalam keadaan terisi penuh dikeluarkan muatannya secara terus menerus
10 A selama 5 jam sampai mencapai tegangan pengeluaran akhir (10,5 V). Maka
kapasitas baterai ialah 50 AH (10 x 5 jam) 1 Oc.
F.
Stiker
Spesifikasi Baterai
Baterai otomotif yang baru memiliki
striker yang ditempelkan untuk memberikan informasi tentang spesifikasi baterai
tersebut, salah satu model stiker baterai seperti tampak dibawah ini Pada
stiker di gambar di atas menunjukkan nomer kode area yaitu N57. Baterai tersebut
memiliki 11 plat per sel dengan nilai 380 Cold
Cranking Ampere dan tegangan baterai yang dihasilkan adalah 12 volt.
G.
Pemeriksaan Baterai (Aki)
Baterai harus diperiksa secara
periodik dan diuji kemampuannya. Terdapat 3 kelompok pemeriksaan dan pengujian
baterai yang sering dilakukan, yaitu:
1.
Pemeriksaan Visual
2. Pemeriksaan
elektrolit dan kebocoran
3. Pengujian
Beban
Pemeriksaan visual meliputi :
1. Kotak
baterai
Kotak baterai sering mengalami
kerusakan yang dapat didentifikasi secara visual, jenis kerusakan kotak baterai
antara lain: kotak retak akibat benturan, mengembang akibat
over charging, bocor akibat keretakan atau mengembang
2. Sel-sel
baterai
Sel baterai sering mengalami
gannguan yaitu sell yang mengembang akibat over charging maupun mengkristal dan
sel yang rontok karena getaran, kualitas yang kurang baik maupun usia baterai.
3. Terminal
baterai dan konektor kabel
Terminal baterai dan konektor
merupakan bagian baterai yang sering mengalami kerusakan, bentuk kerusakan
paling banyak adalah korosi yang disebabkan oleh uap elektrolit baterai maupun
panas akibat kenektor kendor atau kotor.
4. Jumlah
elektrolit
Jumlah elektrolik perlu diperiksa
secara periodik. Bila
pengisian berlebihan (over charging) maka elektrolit cepat berkurang karena
penguapan berlebihan. Pemeriksaan jumlah elektrolit dapat dilakukan dengan
cepat karena kotak dibuat dari plastic yang tembus pandang. Jumlah
elektrolit harus berada diantara garis Upper Level dan Lower Level.
5. Kabel
Baterai
Kabel baterai dialiri arus
yang sangat besar, saat mesin distarter besar arus dapat mencapai 250 – 500 A,
tergantung dari daya motor starter, dengan arus sebesar itu kabel akan panas.
Panas pada kabel menyebabkan elasitas kabel menurun, isolator muda pecah dan
terkupas, hal ini terjadi terutama pada isolator dekat dengan terminal
baterai.
6. Pemegang
Baterai
Pemengang baterai harus dapat
mengikat baterai dengan kuat agar goncangan baterai dapat dihindari, sehingga
usia baterai dapat lebih lama. Gangguan pada pemegang baterai antara lain
kendor akibat mur pengikat karat untuk itu lindungi mur dengan mengoleskan
vaselin/ grease.
Pemeriksaan Elektrolit adalah jumlah
elektrolit baterai harus selalu dikontrol, jumlah yang baik adalah diantara
tanda batas Upper Level dengan Lower Level. Jumlah elektrolit
yang kurang menyebabkan sel baterai cepat rusak, sedang jumlah elektrolit
berlebihan menyebabkan tumpahnya elektrolit saat batarai panas akibat pengisian
atau pengosongan berlebihan. Akibat proses penguapan saat pengisian memungkinkan
jumlah elektrolit berkurang, untuk menambah jumlah elektrolit yang kurang
cukup dengan menambah H2O atau terjual dengan nama Air Accu.
Penyebab elektrolit cepat berkurang
dapat disebabkan oleh overcharging, oleh karena bila berkurangnya elektrolit
tidak wajar maka periksa dan setel arus pengisian. Keretakan baterai dapat pula
menyebabkan elektrolit cepat berkurang, selain itu cairan elektrolit dapat
mengenai bagian kendaraan, karena cairan bersifat korotif maka bagian kendaraan
yang terkena elektrolit akan korosi.
Pemeriksaan berat jenis elektrolit
baterai menggunakan alat hydrometer. Pemeriksaan berat jenis elektrolit baterai
merupakan salah satu metode untuk mengetahui kapasitas baterai. Baterai penuh
pada suhu 20 ºC mempunyai Bj 1,27-1,28, dan baterai kosong mempunyai Bj 1,100
-1,130.
Berat jenis elektrolit berubah
sebesar 0,0007 setiap perubahan 1 ºC. Spesifikasi berat jenis normal ditentukan
pada 20 ºC, oleh karena itu saat pengukuran temperatur elektrolit
harus diamati. Rumus untuk mengkoreksi hasil pengukuran adalah:
S 20 ºC = St + 0,0007 x (t - 20)
S 20 ºC : Berat jenis
pada temperatur 20 ºC
St : Nilai
pengukuran berat jenis
t : Temperatur
elektrolit saat pengukuran
Contoh:
Tentukan berat jenis baterai bila hasil pengukuran pada temperature 0ºC,
menunjukkan berat jenis 1,260.
S 20
ºC = St + 0,0007 x (t - 20)
= 1,260
+ 0,0007 x ( 0 – 20)
= 1,260 – 0,014
= 1,246
Tindakan yang harus dilakukan
terkait hasil pengukuran elektrolit adalah sebagai berikut:
Tindakan yang
dilakukan berdasarkan hasil pengukuran BJ elektrolit
HASIL PENGUKURAN
|
TINDAKAN
|
1.280 Atau lebih
|
Tambahkan air suling agar berat jenis berkurang
|
1.220 – 1.270
|
Tidak Perlu Tindakan
|
1.210 atau kurang
|
Lakukan pengisian penuh, ukur
berat jenis. Bila masih dibawah 1.210 ganti baterai.
|
Perbedaan antar sel
kurang dari 0.040
|
Tidak perlu tindakan
|
Perbedaan berat jenis antar sel
0.040 atau lebih
|
Lakukan pengisian penuh, ukur
berat jenis. Bila berat jenis antar sel melebihi 0.030, setel berat jenis. Bila tidak
bisa dilakukan, ganti baterai
|
Hydrometer adalah alat untuk
mendeteksi berat jenis pada cairan elektrolit pada baterai. Cara
mengoprasikan Hidro meter sebagai berikut:
1.
Masukan ujung hydrometer kedalam lubang sel sampai
menjentuh permukaan caira elektrolit.
2.
Tekan karet pada ujung hydrometer sampai ke dalam.
3.
Setelah kembali ke posisi semula maka kalian dapat
melihat hasil yang di tentukan pada aurometer.
Cara menghitung hasil penggukururan berat jenis air
elektrolit dapat dilihat pada table diatas sebagai berikut:
a.
Good/warna hijau = Kondisi air elektrolit sangat baik
b. Fair /warna
putih = Kondisi caira accu baik
c. Recharge/warna
merah =Kondisi air elektrolit perlu pengisian / stroom
Kebocoran
Arus disebabkan adanya kebocoran arus listrik menyebabkan baterai mengalami
pengosongan, sehingga bila kendaraan lama tidak digunakan maka energi listrik
yang tersimpan pada baterai dapat berkurang cukup banyak sehingga mesin sulit
dihidupkan.
Mobil sulit distart di pagi hari,
adalah salah satu akibat yang ditimbulkan dari :
1.
Clamp Pengikat kutub + dan – aki yang kurang kencang,
atau timbulnya kerak putih disekitar kepala aki.
2. Kondisi air
accu (electrolit) yang kurang sesuai dengan yang dipersyaratkan di bagian luar
aki.
3. Bagian body
accu sudah mengembung atau bocor.
H.
Perawatan dan Perbaikan Baterai (Aki)
1.
Memeriksa
Tegangan Baterai
a.
Periksa tegangan baterai dengan menggunakan
Multitester, tegangan yang
baik 12 - 13,5 Volt.

b.
Bukalah semua tutup baterai lalu periksa tiap-tiap sel
baterai dengan menggunakan Multitester.

c.
Jika baterai yang diukur 12 Volt berarti tiap sel
harus turun 2 Volt.
d.
Berhati-hatilah jangan sampai merusak sel-sel dari
tiap sel baterai yang di ukur.
2. Memeriksa Kondisi Berat Jenis Cairan Elektolit

Lakukan pemeriksaan dengan
menggunakan Hidrometer, Bacalah pada takaran ukuran yang ada :
Hijau = Sangat Baik
Putih = Baik
Merah = Kurang
Berat jenis standar 1,26-1,28 kg/l
Putih = Baik
Merah = Kurang
Berat jenis standar 1,26-1,28 kg/l
3.
Memeriksa Terminal Baterai
Periksa terminal baterai dari kemungkinan korosif atau
timbul jelaga salju akibat terkena uap dari cairan elektrolit, jika timbul
demikian bersihkan, jangan lupa
periksa juga sambungan-sambungan kabel terminal baterai dari karat atau putus.
Kerusakan-kerusakan
pada baterai :
1.
Kotak baterai retak atau pecah.
2. Sel baterai
rusak.
3. Tutup
baterai tersumbat sehingga baterai melembung.
4. Terminal
baterai korosif.
5. Air aki
selalu kering.
6. Tegangan
baterai selalu turun.
BAB III
PENUTUP
A.
Kesimpulan
Baterai adalah alat listrik-kimiawi
yang menyimpan energi dan mengeluarkan tenaganya dalam
bentuk listrik. Tentunya sebagai alat yang
mengeluarkan energi listrik, baterai mempunyai fungsi yang sangat banyak dan
beraneka ragam.
Baterai ada dua
tipe yaitu baterai kering dan baterai basah. Di dalam baterai mobil terdapat
elektrolit asam sulfat, elektroda positif dan negatif dalam bentuk plat.
Plat-plat dibuat dari timah atau berasal dari timah. Pemeriksaan baterai dapat
dilakukan dengan 2 cara yaitu pemeriksaan secara visual baterai dan pemeriksaan
elektrolit.
B. Saran
Semoga makalah ini
dapat memberikan pengetahuan baru bagi pembaca mengenai baterai, saran penulis
untuk menjaga agar baterai dapat awet dan tahan lama maka perlu dilakukan
pemeriksaan dan perawatan baterai secara berkala.
DAFTAR PUSTAKA
www.Teknikelektronika.com (Diakses 5 Maret 2015)
http://ki-tapunya.blogspot.com (Diakses 5 Maret 2015)
http://fathurrahmanbima.blogspot.com (Diakses 5 Maret 2015)
http://otomotif-komputer.blogspot.com (Diakses 5 Maret 2015)
http://otomotifdasar.blogspot.com (Diakses 5 Maret 2015)
http://nisha-khoerunnisya.blogspot.com
(Diakses 7 Maret 2015)
http://www.kelasrobot.com (Diakses 7 Maret 2015)
http://sanfordlegenda.blogspot.com (Diakses 7
Maret 2015)
http://brainly.co.id
(Diakses 7 Maret 2015)
 22.12
22.12
 Retno Damayanti
Retno Damayanti






















good
BalasHapusgood job
BalasHapus